Структуры кристаллов неорганических соединений, закономерное пространственное расположение атомов, ионов (иногда молекул), составляющих кристаллические вещества. Расшифровка С. к. — одна из основных задач кристаллографии.
В большинстве неорганических соединений молекул нет и имеет место взаимное проникновение бесконечных укладок из катионов и анионов (см. Кристаллическая решётка). Наиболее прост случай структуры, в которой примитивная кубическая решётка (см. Браве решётка) из анионов Cl проложена аналогичной решёткой из катионов Cs; они вставлены одна в другую так, что катион Cs оказывается в центре куба из 8 анионов Cl (и наоборот), т. е. координационное число (КЧ) равно 8 (рис. 1, a). Зачастую разные вещества имеют структуры одинаковые с точностью до подобия (см. Кристаллохимия), так, структурой CsCI обладают CsBr, CsI, а также галогениды таллия и аммония, и все эти структуры объединяются в единый структурный тип CsCI. Понятие структурный тип — один из критериев сходства или различия строения кристаллов; именуют его обычно по названию одного из веществ, кристаллизующихся в нём. Ниже даётся краткое описание некоторых важнейших структурных типов.
В структурном типе галита NaCI и катионы, и анионы расположены по закону кубической плотнейшей упаковки (см. Упаковки плотнейшие). Каждый катион окружен 6 анионами, и наоборот, т. е. КЧ=6. координационный многогранник — октаэдр (рис. 1,б). В структуре галита кристаллизируются почти все галогениды щелочных (LiF, LiCI,..., NaF, NaCI,..., RbF, RbCI,...) и окислы щёлочноземельных элементов (MgO, CaO и др.), важнейший сульфид PbS и др.
В структурном типе сфалерита ZnS, построенном также на основе закона кубической плотнейшей упаковки, атомы Zn с КЧ = 4 находятся в S-тетраэдрах и наоборот. Этот тип характерен для соединений с существенно ковалентными связями; в нём кристаллизируются CuCI, Cul, HgS и др., а также ряд важнейших полупроводниковых соединений (CdS, GaAs и др.) (рис. 1,в).
Более наглядным является «полиэдрический» способ изображения С. к., при котором анионы представлены точками — вершинами координационных многогранников (полиэдров) (рис. 1, а, б, в). Основой этого способа послужило то, что анионы, обладающие большим, нежели катионы, ионным радиусом, предпочтительно располагаются по стандартному узору плотнейшей упаковки. Кроме того, и самих анионов не так уж много (О, S, F и др.), поэтому при описании С. к. достаточно указать только тип укладки анионов. Положение катионов и их КЧ, определяющие специфику С. к., становятся при этом особенно наглядными. Так, на рис. 2, а ясно виден цепочечный характер структуры рутила. TiO2, в котором Ti — октаэдры, связанные друг с другом вершинами, образуют колонки, параллельные ребру элементарной ячейки с. Этот тип структуры распространён среди бинарных соединений (MnO2, SnO2, PbO2, MgF2 и др.). Слоистый характер структурного типа брус и та Mg (OH)2, в котором октаэдры соединены общими ребрами в сплошные слои, иллюстрирует рис. 2, б. В этом типе, помимо ионных, кристаллизируются также многие ковалентные соединения (сульфиды, теллуриды и др.). Структурный тип флюорита CaF2 (рис. 2, в) характерен для соединений с крупными катионами, например CeO2, ThO2 и др. На рис. 2, г показан способ выделения 2/3 заселённых октаэдров в структурном типе корунда Al2O3 — гематита Fe2O3. В структурном типе перовскита CaTiO3 кристаллизуется важнейший сегнетоэлектрик BaTiO3 (рис. 2, д). Крупные катионы Ba, расположенные в полостях каркаса из Ti — октаэдров в координации 12, деформируют кубическую ячейку в псевдокубическую.
Полиэдрический способ позволяет описывать также сложные структурные мотивы, которые отражают пространственное распределение прочнейших связей между атомами (ионами) в структуре. К одному структурному мотиву принадлежат все структурные типы, обладающие одинаковым способом связи атомов или атомных полиэдров в пространстве. Выделяют 6 основных структурных мотивов: координационный, островной, кольцевой, цепочечный, слоистый, каркасный.
Координационный мотив характеризуется равномерным распределением межатомных связей в 3 измерениях (рис. 1, а). К островному относятся структурные типы, заключающие конечные радикалы (острова), прочность связи внутри которых значительно выше, чем с окружающими атомами. Эти радикалы могут быть простыми и иметь линейную (S2, As2, Cl2, S и др.), треугольную (BO3, СО3 и др.), тетраэдрическую (SiO4, PO4, BF4 и др.) формы или сложными, состоящими из двух полиэдров, например B2O5, Si2O7, Tl2Cl9 и т.п., и более сложных ассоциаций. Кольцевой мотив характеризуется наличием в структуре атомов (например, S) или атомных полиэдров (SO4, PO4 и др.), прочно связанных между собой в кольца различной конфигурации (трёх-, четырёх-, шести-, девятичленные и др.). Цепочечный мотив в отличается ярко выраженной линейной направленностью прочнейших связей в структуре, т. е. ассоциацией атомов (Se, Te и др.) или атомных полиэдров (SiO4, BO4, РО4; BO4; TiO6, ZrO6 и др.) в одном измерении. Цепочки могут быть как простыми, так и сдвоенными (ленты), например [Si4O11] n6n-.[Sb4S6] n0, или более сложной формы. Слоистый мотив характеризуется бесконечной в двух измерениях ассоциацией атомов или атомных полиэдров, образующих т. н. сетки. Этот мотив свойствен слюдам и им подобным слоистым силикатам. Встречаются также в графите, молибдените MoS2, ковеллине Cu2CuS2S и др. Каркасный мотив, также как и координационный, имеет равномерное распределение связей в пространстве, но общими элементами атомных полиэдров являются в основном вершины. Это обусловливает большую рыхлость структурных типов, полости в которых могут заполняться крупными катионами. Обычная форма полиэдров — тетраэдр (SiO4, PO4, BO4, AlO4 и др.) или октаэдр (MoO6, WO6 и др.).
Пять последних мотивов особенно характерны для силикатов и алюмосиликатов, у которых важнейшая роль принадлежит не простейшим одноатомным анионам, а тетраэдрической группе SiO4. Этот элементарный силикатный «кирпич» в большинстве силикатов конденсируется либо в кольца, либо в бесконечные радикалы в одном, двух или трёх измерениях. См. рис. в ст. Силикаты природные.
Лит.: Белов Н. В., Структура ионных кристаллов и металлических фаз. М., 1947; его же, Очерки по структурной минералогии, в кн.: Минералогический сборник, Львов, 1950—75.
Н. В. Белов.

Рис. 2. Структурные типы рутила TiO2 (a), брусита Mg(OH)2 (б), флюорита CaF2 (в), корунда Al2O3 (г), перовскита CaTiO3 (д) в полиэдрическом изображении.
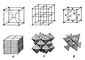
Рис. 1. Структуры: а — CsCl; б — NaCl; в — ZnS. Вверху — общий вид; внизу — полиэдрическое изображение.