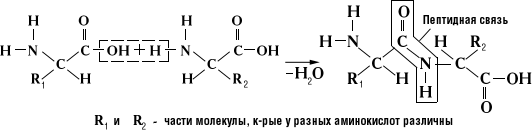
Пептидная связь, вид амидной связи; возникает при образовании белков и пептидов в результате взаимодействия a-аминогруппы (—NH2) одной аминокислоты с a-карбоксильной группой (—СООН) др. аминокислоты: 
Группа —СО—NH— в белках находится в состоянии кето-енольной таутомерии. 
Наличие П. с. в белках и пептидах было предположено А. Я. Данилевским и Э. Фишером и затем подтверждено химическими и физическими данными. Благодаря таутомерии П. с. имеет частично (на 40%) характер двойной (сопряжённой) связи, что проявляется в уменьшении её длины (1,32Å), по сравнению с длиной одинарной —С—N— связи (1,47Å) (см. Химическая связь). Частично сопряжённый характер — С—N— связи обусловливает плоскую конфигурацию —СО—NH— группы (все 4 атома компланарны, то есть находятся в одной плоскости) и существование транс- и цис-форм:
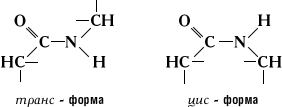
Экспериментально доказана большая устойчивость транс-формы (см. Изомерия). Ферментативное образование П. с. в живых клетках происходит в процессе биосинтеза белка. Разработаны методы химического и ферментативного лабораторного синтеза и расщепления П. с., позволившие синтезировать ряд биологически активных пептидов, а также установить аминокислотную последовательность для многих белков и пептидов.
Н. Н. Зайцева.