 (для органолюминофоров) до единиц
(для органолюминофоров) до единиц 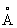 (для кристаллофосфоров, активированных редкоземельными элементами) и сильно зависит от концентрации Л. и активатора, а также от температуры.
(для кристаллофосфоров, активированных редкоземельными элементами) и сильно зависит от концентрации Л. и активатора, а также от температуры.Люминофоры (от латинского lumen — свет и греческого phoros — несущий), твёрдые и жидкие вещества, способные люминесцировать под действием различного рода возбуждений (см. Люминесценция). По типу возбуждения различают фотолюминофоры, рентгенолюминофоры, радиолюминофоры, катодолюминофоры, электролюминофоры. Некоторые Л. могут выступать в качестве Л. смешанных типов (например, ZnS·Cu является фото-, катодо- и электролюминофором). По химической природе различают органические Л. — органолюминофоры, и неорганические — фосфоры. Фосфоры, имеющие кристаллическую структуру, называются кристаллофосфорами.
Свечение Л. может быть обусловлено как свойствами основного вещества, так и наличием примеси — активатора. Активатор образует в основном веществе (основании) центры свечения. Название активированных Л. складывается из названия основания и названия активаторов, например: ZnS·Cu, Co обозначает Л. ZnS, активированный Cu и Со. Если основание смешанное, то перечисляют сначала названия оснований, а затем активаторов (например, ZnS, CdS·Cu, Со).
Л. применяют для преобразования различных видов энергии в световую. В зависимости от условий применения предъявляются определённые требования к тем или иным параметрам Л.: типу возбуждения, спектру возбуждения (для фотолюминофоров), спектру излучения, выходу излучения (отношению излученной энергии к поглощённой), временным характеристикам (времени возбуждения свечения и длительности послесвечения). Наибольшее разнообразие параметров можно получить у кристаллофосфоров, варьируя активаторы (в основном тяжёлые металлы) и состав основания, причём в зависимости от концентрации активаторов свойства Л. в значительной степени меняются. Например, для ZnS·Cu при концентрации Cu 10-5 г/г оптимальным является фотовозбуждение, а при концентрации Cu > 10-4 г/г — электровозбуждение.
Спектр возбуждения различных фотолюминофоров меняется от коротковолнового ультрафиолетового до ближнего инфракрасного. Спектр излучения может лежать в видимой, инфракрасной и ультрафиолетовой областях. Ширина спектральных полос излучения отдельных Л. меняется от тысяч  (для органолюминофоров) до единиц
(для органолюминофоров) до единиц 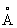 (для кристаллофосфоров, активированных редкоземельными элементами) и сильно зависит от концентрации Л. и активатора, а также от температуры.
(для кристаллофосфоров, активированных редкоземельными элементами) и сильно зависит от концентрации Л. и активатора, а также от температуры.
Энергетический выход излучения Л. зависит от вида возбуждения, его спектра (при фотолюминесценции) и механизма преобразования энергии в световую. Он резко падает при повышении концентрации Л. и активатора (концентрационное тушение) и температуры (температурное тушение). Яркость люминесценции Л. нарастает с начала возбуждения в течение промежутка времени от 10-9 сек до нескольких мин. Длительность послесвечения различных Л. колеблется от 10-9 сек до нескольких ч и определяется характером преобразования энергии и временем жизни возбуждённого состояния. Наиболее короткое время послесвечения имеют органолюминофоры, наиболее длительное — кристаллофосфоры. В зависимости от условий применения могут играть существенную роль и другие свойства Л. — стойкость к действию света, тепла, влаги и так далее.
Основными типами применяемых Л. являются кристаллофосфоры, органические Л., люминесцирующие стекла. Наибольшее распространение получили кристаллофосфоры. Значительная часть их представляет собой полупроводниковые соединения с шириной запрещенной зоны 1—10 эв, люминесценция которых обусловлена примесью (активатора) или дефектами решётки. Концентрация активатора варьируется в пределах 10-3—10-7 г/г. Некоторые посторонние примеси, например Fe, в концентрациях уже 10-6 г/г могут уменьшать яркость люминесценции, поэтому приготовление Л. требует особого контроля чистоты исходных материалов. Такие Л. изготовляют путём прокалки шихты. Для улучшения процесса кристаллизации в шихту добавляются плавни — соли типа KCI, LiF, CaCI2 и тому подобные. Люминесцирующие монокристаллы выращиваются из расплава, раствора или газовой фазы.
В люминесцентных лампах применяются смеси кристаллофосфоров [например, смеси MgWO4 и (ZnBe)2 SiO4·Mn] или однокомпонентные Л., например галофосфат кальция, активированный Sb и Mn. Л. подбираются так, чтобы их свечение имело спектральное распределение, близкое к распределению дневного света. Катодолюминофоры применяют для экранов электронно-лучевых трубок, осциллографов, черно-белых и цветных кинескопов и тому подобное. Для цветных кинескопов разработаны люминофоры, дающие три основных цвета свечения: синий (ZnS·Ag), зелёный (ZnSe·Ag), красный [Zn3(PO4)2·Mn]. Для рентгеноскопии применяются (Zn, Cd) S·Ag и CaWO4, дающие свечение в области максимальной чувствительности глаза и позволяющие максимально использовать чувствительность рентгеновской плёнки и уменьшить дозу облучения. Электролюминофоры на основе ZnS·Cu используют для создания светящихся индикаторов, табло, панелей.
Органические Л. могут люминесцировать в растворах (флуоресцеин, родамин) и твёрдом состоянии (пластические массы и антрацен, стильбен и другие органические кристаллы). Органические Л. могут обладать ярким свечением и очень высоким быстродействием. Цвет люминесценции органических Л. может быть подобран для любой части видимой области. Они применяются для люминесцентного анализа, изготовления люминесцирующих красок, указателей, оптического отбеливания тканей и т.д. Многие органические Л. (красители цианинового, полиметинового рядов и другие) используют в качестве активных элементов жидкостных лазеров. Кристаллические органические Л. применяют в качестве сцинтилляторов для регистрации g-лучей и быстрых частиц (см. Сцинтилляционный счётчик и Люминесцентная камера). Органические Л. выпускаются промышленностью СССР под торговым наименованием люминоры.
Люминесцирующие стёкла изготовляют на основе стеклянных матриц различного состава. При варке стекла в шихту добавляют активаторы, чаще всего соли редкоземельных элементов или актиноидов. Выход, спектр и длительность свечения люминесцентных стекол определяются свойствами активатора. Они обладают хорошей оптической прозрачностью и многие из них могут быть использованы в качестве лазерных материалов, а также для визуализации изображений, полученных в ультрафиолетовом излучении.
Э. А. Свириденков.