Кремнийорганические соединения, класс химических соединений, содержащих в молекулах связь кремний — углерод. К. с. подразделяют на следующие группы.
1) Органогалогенсиланы [алкил (арил)-галогенсиланы] RnSiX4-n; органогидридгалогенсиланы RnSiHmX4-(n+m) (где Х — чаще Cl); органоалкоксисиланы RnSi (OR')4-n; органоацилоксисиланы RnSi (OCOR')4-n; органоаминосиланы RnSi (NH2)4-n.
2) Органосиланы (замещенные силаны) RnSiH4-n.
3) Органосилоксаны, включающие дисилоксаны R3SiOSiR3, трисилоксаны R3SiOSi (R2) OSiR3 и т. д.; циклосилоксаны (R2SiO) n, где n = 3—10 (чаще 3—4)
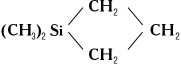
4) Гетероциклические соединения, например диметилсилациклобутан

К соединениям первых двух групп примыкают близкие им по химическим свойствам соответствующие неорганические аналоги, такие, как галогенсиланы SiHmX4-m (см. Кремния галогениды), силаны SixHy (см. Кремневодороды), а также алкоксисиланы Si (OR)4.
Получение. В промышленности наиболее важные К. с. получают главным образом непосредственным взаимодействием хлористых алкилов (арилов) с кремнием в присутствии меди; наряду с главным продуктом реакции 2RCI+Si®R2SiCl2 образуется смесь различных соединений (RSiCI3, R3SiCl, RHSiCl2 и др.), которые также находят применение в промышленности, например для синтеза К. с. более сложной структуры или полимеров. К. с. получают также реакциями с металлоорганическими соединениями: CH3SiCl3+C6H5MgCl®CH3(C6H5) SiCl2+MgCI2; термической конденсацией: CH3SiHCl2+CH2=CHCl®CH3(CH2=CH) SiCl2+HCI; жидкофазной дегидроконденсацией: CH3SiHCl2+C6H6®CH3(C6H5) SiCl2+H2; присоединением органогидридхлорсиланов к ненасыщенным соединениям: CH3SiHCl2+RCH=СН2®CH3(RCH2CH2) SiCl2. Алкокси- и ацилоксисиланы получают чаще всего взаимодействием органохлорсиланов со спиртами, кислотами и др.
| Соединение | tкип °C | Плотность при 20°С, г/см3 |
| Диметилдихлорсилан (СН3)2SiCl2 | 70,1 | 1,0637 |
| Триметилдихлорсилан (СН3)3SiCl | 57,7 | 0,8580 |
| Диэтилдихлорсилан (С2Н5)2SiCl2 | 128,9 | 1,0504 |
| Триэтилхлорсилан (С2Н5)3SiCl | 146,0 | 0,8968 |
| Винилтрихлорсилан CH2=CHSiCl3 | 92,5 | 1,2426 |
| Фенилтрихлорсилан C6H5SiCl3 | 201,0 | 1,3240 |
| Дифенилдихлорсилан (C6H5)2SiCl2 | 304,0 | 1,2216 |
| Метилфенилдихлорсилан CH3(C6H5) SiCl2 | 205,5 | 1,1866 |
| Метилтриметоксисилан CH3Si (OCH3)3 | 103—105 | — |
| Метилтриметоксисилан CH3Si (OC2H5)3 | 151 | 0,9383 |
| Этилтриэтоксисилан C2H5Si (OC2H5)3 | 159 | 0,9207 |
| Тетраэтоксисилан (C2H5O)4Si | 166,5 | 0,9676 |
Свойства и применение. Почти все К. с. — бесцветные жидкости (см. табл.); лишь некоторые из них, например циклосилоксаны (R2SiO)3, — твёрдые кристаллические вещества. Обычно К. с. термически устойчивы (~600°С), перегоняются при атмосферном давлении и в вакууме; хорошо растворяются в углеводородах, хлорированных углеводородах, эфирах и др. органических растворителях; с водой не смешиваются. К. с. легко гидролизуются, особенно органохлорсиланы (дымят на воздухе):
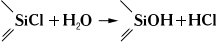
Образующиеся при гидролизе органогидроксисиланы вступают в межмолекулярную конденсацию с образованием органосилоксанов:

Под влиянием выделяющейся (или вводимой) кислоты происходит поликонденсация с образованием кремнийорганических полимеров. В соответствии с числом способных к гидролитическому отщеплению групп (обычно хлор, иногда алкокси-, ацилокси- или аминогруппы) различают моно-, ди-, три- и тетрафункциональные К. с., образующие при гидролизе соответственно дисилоксаны, смесь линейных полимеров HO (R2SiO) nH и низкомолекулярных циклических диорганосилоксанов (R^SiO) n (в основном n= 4), полимеры циклолинейной и сшитой структур (RSiO1,5) n и (SiO2) n.
Циклические диорганосилоксаны (главным образом тримеры и тетрамеры), образующиеся также при термокаталитической деструкции (щелочь, 150—400°С) полимеров, содержащих концевые гидроксильные группы, используют для производства кремнииоиганических каучуков и кремнийорганических жидкостей. Смесь тетраэтоксисилана с продуктами его частичного гидролиза под техническим названием «этилсиликат» используют при приготовлении форм для точного литья по выплавляемым моделям.
С. А. Голубцов.